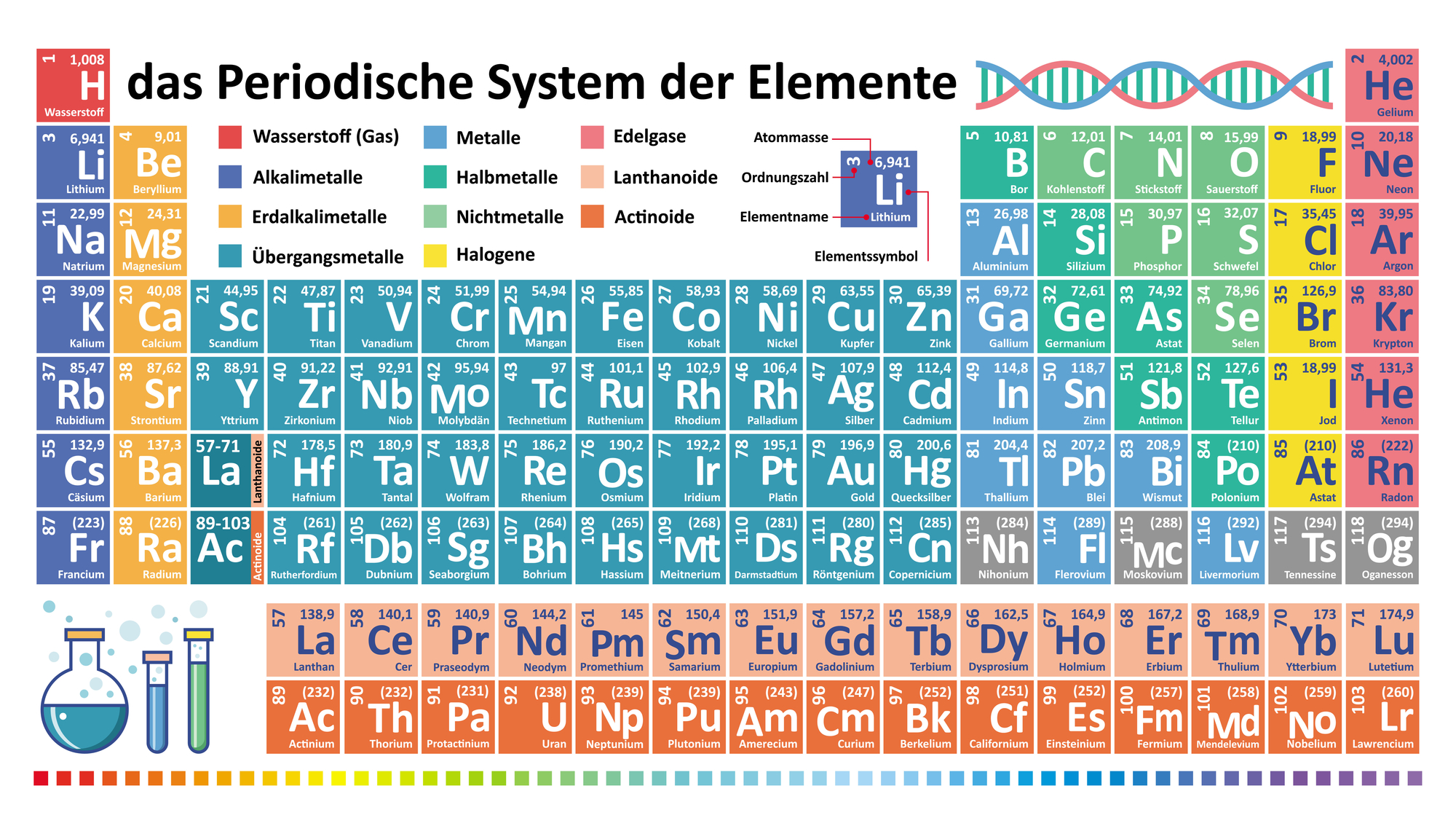
In jedem Chemieraum hängt es meistens als großes Plakat an der Wand, damit die Klasse es gut erkennen kann. Ansonsten hast du es bestimmt schon mal in deinem Chemiebuch gesehen – das Periodensystem. Auf den ersten Blick ist es manchmal etwas schwer zu überschauen und sieht ein bisschen kompliziert aus. Dabei steckt durchaus eine Ordnung dahinter. Was das Periodensystem darstellt und wie es aufgebaut ist, erfährst du hier.
Was ist ein Periodensystem?
Das Periodensystem erfüllt in der Chemie eine wichtige Aufgabe. Es fasst alle chemischen Elemente in einer Übersicht zusammen. Zudem sagt es etwas über ihre individuellen Kernladungszahlen, Besonderheiten und ihre Masse aus. Alle Namen der Elemente sind vollständig ausgeschrieben, zusätzlich erscheinen sie in abgekürzter Form. Jeder Stoff ist mit einer Zahl versehen. Die Nummern geben die jeweilige Protonenanzahl im Atomkern an. Die Anzahl der Protonen steigt von links nach rechts an. Im Periodensystem gibt es insgesamt sieben Perioden sowie 18 Gruppen. Sie sind wiederum in vier Blöcke (s-, d-, p- und f-Block) eingeteilt. Bei manchen Darstellungen nimmt der f-Block eine eigenständige Position ein, er liegt etwas versetzt unter dem eigentlichen Periodensystem. Die darin enthaltenen Elemente werden in die Kategorien Lanthanoide und Actinoide unterteilt. Namensgebend waren die beiden Stoffe Lanthan und Actinium.
[su_divider top=“no“ divider_color=“#eeeeee“]
[quads id=1]
[su_divider top=“no“ divider_color=“#eeeeee“]
Hinweis: Periodensystem ist nicht gleich Periodensystem. Im Laufe der Zeit wurden unterschiedliche Modelle entwickelt, abgeändert oder um neue Elemente erweitert. Am häufigsten findet die mittellange Variante Verwendung.
Was steht wo? Der Aufbau des Periodensystems
Der Name Periodensystem sagt schon eine Menge aus. Sein gesamter Aufbau erfolgt systematisch, die Elemente nehmen ihren Platz also nicht zufällig ein. Je mehr Protonen ihr Kern beinhaltet, umso weiter stehen sie rechts. Überdies sind Elemente mit ähnlichen Eigenschaften als kleine Gruppen angeordnet. Das Wort Periode verweist auf diese gleichbleibenden Merkmale. Halogene gelten beispielsweise als besonders reaktionsfähig, Edelgase reagieren hingegen kaum mit anderen Stoffen. Deshalb stehen die einzelnen Elemente dieser Gruppen dicht beieinander.
Im Periodensystem werden für die Kästchen verschiedene Farben benutzt. Auf diese Weise lassen sich Metalle, Halbmetalle und Nichtmetalle klarer voneinander unterscheiden. Darüber hinaus sind ihre jeweiligen Erscheinungsformen farbig angegeben. Dasselbe gilt für die Differenzierung zwischen radioaktiv und nicht radioaktiv. Auf diese Weise kannst du herausfinden, ob das Element fest, flüssig oder gasförmig ist und inwieweit es radioaktive Fähigkeiten besitzt.
Elemente mit natürlichem beziehungsweise nicht natürlichem Vorkommen werden ebenfalls entsprechend gekennzeichnet.
[su_divider top=“no“ divider_color=“#eeeeee“]
[quads id=2]
[su_divider top=“no“ divider_color=“#eeeeee“]
Ein Überblick am Beispiel Wasserstoff
Zur Veranschaulichung erhältst du hier eine Übersicht, welche Angaben sich in einem Elementkästchen befinden.
Im Periodensystem steht der Wasserstoff ganz oben auf der linken Seite. Daher hat er seinen Platz in der ersten Gruppe sowie in der ersten Periode. Das Element ist mit dem Buchstaben H’abgekürzt (vom lateinischen hydrogenium = Wasserstoff), in der Mitte des Kästchens kannst du seinen vollständigen Namen lesen. Oben links im Kästchen ist die Ordnungszahl 1 zu sehen: Ein Wasserstoff-Atomkern besitzt also nur ein Proton. Des Weiteren ist die Masse in der Einheit u angegeben. Im Falle von Wasserstoff liegt der Wert bei 1,008 u, seine Dichte bei 0,08 g/l.
Am unteren Rand steht häufig noch die Elektronegativität vom Wasserstoff. Sie gibt an, wie viele Elektronenpaare der Stoff annehmen kann. Beim Wasserstoff sind es 2,2 χ.
An der Farbgebung des Kästchens lassen sich weitere Eigenschaften ablesen. Als Hilfestellung kannst du die Legende verwenden. Sie gibt alle Farben samt Elementgruppen an. Wasserstoff ist nicht metallisch, gasförmig und hat keine radioaktive Wirkung. Darüber hinaus gilt es als natürliches Element.
…einmal mit Radium…
Ein Blick auf das Periodensystem verrät folgende Informationen über den chemischen Stoff Radium: Das dazugehörige Kästchen befindet sich sowohl in der zweiten Gruppe als auch in der siebten Periode.
Der Name Radium wird in der Kurzform ‚Ra‘ wiedergegeben, seine Ordnungszahl ist die 88. Also besteht ein Radium-Atomkern aus insgesamt 88 Protonen. Seine Masse beträgt etwa 226 u, die Elektronegativität 0,9 χ.
Anders als beim Wasserstoff kannst du im Radium-Kästchen eine Reihe Punkte unter den Buchstaben ‚Ra‘ erkennen. Sie bedeuten, dass Radium kein stabiles Isotop ist, sondern zerfällt. Dieses Merkmal ist für radioaktive Stoffe charakteristisch. Am Periodensystem lässt sich zudem feststellen, dass Radium zur Gruppe der Metalle gehört, im festen Zustand vorliegt und seine Dichte 5,50 g/cm³ beträgt. Er ist kein künstlicher Stoff, sondern kommt in der Natur vor.
[su_divider top=“no“ divider_color=“#eeeeee“]
[quads id=3]
[su_divider top=“no“ divider_color=“#eeeeee“]
… und zum Schluss mit Quecksilber
Bisher war von gasförmigen und festen Elementen die Rede. Zur Vervollständigung kommt nun ein flüssiger Stoff hinzu, nämlich das Quecksilber. Du kennst es vielleicht noch aus alten Thermometern. Quecksilber gehört einerseits in die zwölfte Gruppe, andererseits wird es zur sechsten Periode dazugezählt. Abgekürzt wird er mit der Formel ‚Hg‘ (vom griechischen ‚hydrargyros‘ – ’silberfarbig‘). 80 Protonen sitzen in einem Quecksilber-Atomkern. Der Stoff hat eine Masse von rund 200 u sowie eine Dichte von 13,55 g/cm³. Seine Elektronegativität wird mit 2,0 χ angegeben.
Überdies weist Quecksilber eine flüssige Beschaffenheit auf. Ähnlich wie Radium ist es ebenfalls ein metallisches Element, allerdings fehlen ihm die radioaktiven Eigenschaften. Quecksilber wird nicht künstlich erzeugt, sondern es zählt zu den natürlichen Stoffen. Darin besteht eine weitere Gemeinsamkeit mit Wasserstoff und Radium.